Secara umum, teori kinetik gas dibangun berdasarkan beberapa asumsi berikut ini:
- Gas terdiri atas partikel-partikel yang dinamakan molekul-molekul dengan jumlah yang sangat banyak.
- Molekul-molekul gas bergerak secara acak dan mematuhi hukum-hukum Newton tentang gerak.
- Molekul-molekul itu berperilaku sebagai partikel titik yang ukurannya sangat kecil jika dibandingkan dengan jarak rata-rata antarpartikel dan ukuran wadahnya.
- Tumbukan antarmolekul dan tumbukan molekul dengan dinding wadah bersifat lenting sempurna.
- Gaya antarmolekul gas dapat diabaikan, kecuali selama tumbukan. Selama proses tumbukan, molekul memberikan gaya ke dinding wadah.
A. Tekanan dan Energi Kinetik Gas Monoatomik
Setiap benda yang bergerak memiliki energi kinetik. Gas terdiri atas partikel yang bergerak, berarti partikel-partikel gas memiliki energi kinetik. Misalkan sebuah bejana berbentuk kubus dengan sisi L yang dindingnya elastis sempurna. Kubus tersebut berisi sejumlah partikel gas. Sebuah partikel bermassa m bergerak menuju salah satu dinding kubus dalam arah sumbu-x negatif dengan kecepatan 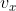 . Setelah menumbuk dinding elastis, momentum partikel itu berubah. Oleh karena dinding bejana bersifat elastis, laju partikel saat terpantul sama dengan lajunya saat akan menumbuk dinding bejana (
. Setelah menumbuk dinding elastis, momentum partikel itu berubah. Oleh karena dinding bejana bersifat elastis, laju partikel saat terpantul sama dengan lajunya saat akan menumbuk dinding bejana (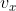 ) dalam arah berlawanan. Besar perubahan momentum yang dialami partikel gas itu adalah
) dalam arah berlawanan. Besar perubahan momentum yang dialami partikel gas itu adalah
Setelah menumbuk dinding kiri dengan laju 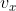 , partikel dipantulkan ke kanan dengan laju
, partikel dipantulkan ke kanan dengan laju 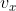 hingga menumbuk dinding kanan. Partikel ini kemudian dipantulkan lagi ke kiri dengan laju
hingga menumbuk dinding kanan. Partikel ini kemudian dipantulkan lagi ke kiri dengan laju 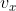 hingga menumbuk dinding kiri bejana, demikian seterusnya. Interval waktu yang diperlukan partikel untuk bergerak bolak-balik dalam bejana adalah
hingga menumbuk dinding kiri bejana, demikian seterusnya. Interval waktu yang diperlukan partikel untuk bergerak bolak-balik dalam bejana adalah
Berdasarkan Hukum II Newton, gaya rata-rata yang diberikan oleh dinding bejana pada partikel gas itu adalah
Nilai rata-rata tekanan P dinding bejana adalah
Nilai energi kinetik gas tersebut adalah
B. Temperatur dan Energi Kinetik Gas
Berdasarkan persamaan umum gas ideal, yaitu
dapat diperoleh nilai energi kinetik partikel gas adalah
Energi kinetik rata-rata partikel gas adalah
Energi kinetik translasi total per mol dari molekul-molekul gas ideal adalah sebanding dengan temperaturnya. Dengan demikian, semakin tinggi temperatur gas, semakin cepat molekul gas itu. Besar kecepatan efektif  molekul gas dapat ditentukan dengan:
molekul gas dapat ditentukan dengan:
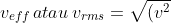_{av}}=\sqrt{\frac{3kT}{m}})
C. Teorema Ekipartisi Energi
Energi mekanik rata-rata per molekul atau energi kinetik rata-rata per molekul gas secara umum dirumuskan dengan:








0 Comments:
Posting Komentar